Cualquiera que haya estudiado un poco de química sabe que si un átomo de carbono en una molécula está unido a cuatro átomos diferentes, es decir, no tiene ningún doble ni triple enlace, estos cuatro enlaces se forman a lo largo de los segmentos que van del centro de un tetraedro (ocupado por el carbono) a los vértices, ocupados por los ligandos. Es lo que se llama estructura tetraédrica.
Ahora investigadores de
En química orgánica, como decíamos arriba, los átomos de carbono enlazados a cuatro grupos orgánicos son casi invariablemente tetraédricos, a no ser que se les fuerce estéricamente (una forma de decir que se les empuja) a que adopten otras formas. El equipo, encabezado por Stephen Liddle, consiguió estabilizar la estructura plana cambiando dos grupos orgánicos por litio
La idea de usar metales alcalinos (el litio es uno) para estabilizar la configuración plana no es nueva. Fue Paul von Schleyer, actualmente en
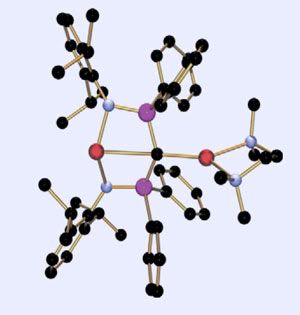
El compuesto que han conseguido ahora es claramente monomérico, según se ha establecido por difracción de rayos-X, con lo que no hay dudas de a qué átomo de carbono pertenece cada átomo de litio. Por otra parte en esta molécula los litios están en disposición trans (a lados opuestos del carbono central). Los ligandos orgánicos son moléculas de tetrametiletilendiamina unidas a un átomo de fósforo (en púrpura) que es el que se une al carbono (en negro). El nitrógeno de la amina (en azul) ayuda a bloquear la estructura. Hemos de hacer notar, siendo muy estrictos, que la estructura no es cien por cien plana, y de que ha sido necesario hacer modelizaciones por ordenador para estar seguros de que ambos litios estén enlazados a la vez al carbono.
Y, ¿cuál es la aplicación de este hallazgo? A priori ninguna más allá de la expansión del conocimiento. Es el tipo de cosas que se hacen porque alguien dijo que no podían hacerse y otro dijo que a lo mejor sí. La situación es parecida a las matemáticas y la física. Alguien desarrolla toda una teoría matemática, Ricci-Curbastro los tensores por ejemplo, sin tener en mente una aplicación física o de cualquier otra índole; entonces llega otro alguien, un científico, en este ejemplo Einstein, y decide que esa teoría que no servía para nada le puede ser útil para explicar la relatividad general. Las necesidades farmacéuticas, químico industriales, biotecnológicas o de cualquier otro tipo pueden que encuentre un uso de este logro dentro de algún tiempo. De momento nos quedamos con un rotundo “se puede hacer y sabemos como hacerlo”.
Referencia:
Cooper OJ, Wooles AJ, McMaster J, Lewis W, Blake AJ, & Liddle ST (2010). A Monomeric Dilithio Methandiide with a Distorted trans-Planar Four-Coordinate Carbon. Angewandte Chemie (International ed. in English) PMID: 20589822
1 comentario:
Gran hallazgo. Estoy impresionado. Como químico (de formación, aunque no ejerzo como tal), tengo que decirte que el efecto estérico tiene mucha importancia en los diseños moleculares de fármacos. Conseguir esta proeza seguro tendrá aplicaciones algún día. Me ha encantado tu último párrafo -la investigación básica-, parece que inevitable que todo el mundo ante un descubrimiento, pregunte ¿y esto pá qué sirve?... así nos va.
Muchas gracias por compartirlo, César.
Un cordial saludo
Publicar un comentario