En muchas ocasiones, cuando nos
enfrentamos a la derivación de las expresiones matemáticas que
representan sistemas físicos la mezcla precisamente de conceptos
matemáticos y físicos hace que ni sigamos unos ni entendamos los
otros. Nosotros pensamos que explicar ambas por separado ayuda en
gran medida a la comprensión general.
Ayer, el hijo de un amigo nos planteaba
que aceptaba la forma de los orbitales del átomo de hidrógeno y la
aparición de los números cuánticos (salvo el de espín) como si
fuesen un dogma, declarándose incapaz de seguir ni a su profesor ni
a su libro de texto (el chaval estudia segundo de químicas en una
prestigiosa universidad española). Es mi opinión que ello se debe a
que las matemáticas y la física ya son lo suficientemente sutiles
(me niego a aceptar que sean complicadas) por separado como, para
encima, mezclarlas.
Lo que sigue es una explicación, un
esquema conceptual si se quiere, de cómo se llega a los
orbitales del átomo hidrogenoide (un átomo que tenga sólo un
electrón) y a los 3 números cuánticos asociados (el de espín va
aparte) desde un punto de vista matemático. Una vez que se tiene
claro “cómo” lo haces ya te puedes concentrar en “qué”
haces. Como conocimientos previos está saber lo que es una ecuación
diferencial y cómo se resuelve en términos generales.
La llamada función de onda, que es la
que describe la posición del electrón (por simplicidad excluimos la
dependencia del tiempo), no es más que una función de tres
variables que viene descrita por una ecuación diferencial llamada
ecuación de Schrödinger (EdS) que adopta la forma
HΨ
= EΨ [EdS]
donde H es un operador llamado
hamiltoniano. Este operador a su vez lo podemos
expresar de tal manera que la EdS la podemos escribir como
HΨ=
aΔΨ
+ bΨ/r
= EΨ [EdS]
en
la que a
y b
son constantes, Δ es el operador laplaciano y r
es una distancia (la del electrón al núcleo). El operador
laplaciano no es más que la suma de las derivadas parciales segundas
con respecto a cada una de las tres variables, es decir:
a(∂2Ψ /∂x2 + ∂2Ψ /∂y2 + ∂2Ψ /∂z2) + bΨ/r = EΨ [EdS]
a(∂2Ψ /∂x2 + ∂2Ψ /∂y2 + ∂2Ψ /∂z2) + bΨ/r = EΨ [EdS]
r
= (x2+y2+z2)1/2
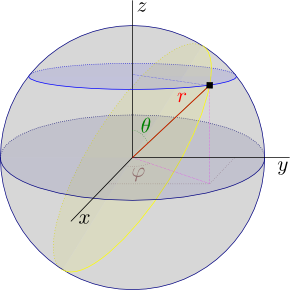 |
| Coordenadas esféricas físicas. |
La
resolución de esta ecuación diferencial nos proporcionará Ψ,
que es lo que queremos. Sin embargo esta resolución en coordenadas
cartesianas se hace muy complicada y es preferible usar coordenadas
esféricas. En estas coordenadas Ψ
pasa
de ser una función de
x, y, z a
ser una función de
r, θ y
φ donde
x
= r sen θ cos φ
y
= r sen θ sen φ
z
= r cos θ
Haciendo
la sustitución resulta que la función Ψ
puede
expresarse como el producto de tres funciones cada una de una sola
variable, Ψ=
R(r)Θ(θ)Φ(φ),
con
lo cual obtenemos tres ecuaciones diferenciales independientes, cada
una en una sola variable. Ya sólo nos queda resolver estas
ecuaciones. No vamos a entrar aquí en cómo se hace, nos limitaremos
a señalar unos detalles matemáticos que después se revelarán como
muy importantes.
En
la resolución de Φ(φ)
nos
va a aparecer una constante de separación que, convencionalmente
(tiene un sentido físico), llamaremos m.
Para que se cumpla que Φ(φ)
= Φ(φ
+2π),
m
sólo puede ser un número entero (positivo, negativo o cero).
La
resolución de Θ(θ)
es más complicada. En ella aparece de nuevo m
y una nueva constante de separación l.
Las condiciones que deben cumplir las soluciones (que sean
cuadráticamente integrables) obligan a que l
= |m|,
|m|+1,
|m|+2,....
Esto quiere decir que el valor más pequeño de l
es cero y que m
va
de -l
a +l
de 1 en 1.
Finalmente,
en la resolución de R(r)
aparece de nuevo l
y
otra constante de separación n
que, por un razonamiento análogo al anterior resulta que debe ser
mayor o igual a l+1.
Deducimos de aquí que el valor más pequeño de n
es 1.
Es
necesario recordar que estas soluciones no son funciones únicas sino
familias de funciones que cumplen los condicionantes de la EdS y que
los distintos miembros de las familias vienen dados por los distintos
valores permitidos de n,
l y
m.
Y esto es matemáticas, no física.
Bien,
pues ya tenemos encontradas las soluciones a la EdS, que tienen la
forma general
Ψ
= Rnl(r)Θlm(θ)Φm(φ)
donde,
como hemos visto,
n
= 1,2,3,...
l
= 0,1,2,...,n-1
m
=
-l,
-l+1,...,0,...,l-1,l
Veamos
el aspecto de algunas de estas soluciones. Si hacemos n
=1, ello implica que l
= 0 y m
= 0. En este caso Θ(θ)
y Φ(φ)
se hacen constantes y
Ψ
=Ψ(r) = AeBr
(A,B
son constantes de integración)
Para
n = 2 tenemos esta misma posibilidad ( l
= 0 y m
= 0) y tres más a partir de l=1
con m =
+1,0,-1, a saber,
Ψ
= CeBr
Ψ
=
D
r sen θ cos φ
eBr
Ψ
= D
r sen θ sen φ eBr
Ψ
= D r cos θ eBr (C, D son constantes de
integración)
Y así podríamos seguir para los
distintos valores de n, l y m encontrando todos
los miembros de la familia de funciones que son solución de la EdS.
Aproximémonos ahora un poco a la
terminología física. La representación de las funciones que sólo
dependen de r será una esfera, llamemoslas s y
distingámolas por el valor de n:
1s
= AeBr
2s
= CeBr
Las funciones que tengan l =1,
llamémoslas p, distingámolas por su valor de n
y marquemos con un subíndice su orientación en ejes cartesianos
(transformamos ahora de esféricas a cartesianas):
2px
= D r sen θ
cos φ eBr =
D x eBr
2py
= D
r sen θ sen φ
eBr
= D y eBr
2pz
= D r cos θ
eBr
= D z eBr
Tenemos de esta forma las funciones de
onda reales hidrogenoides para n
=1 y n = 2. Un orbital es una función de onda
espacial de un electrón. Puesto que en un átomo hidrogenoide solo
tiene un electrón, todas sus funciones de onda son orbitales. Éstos
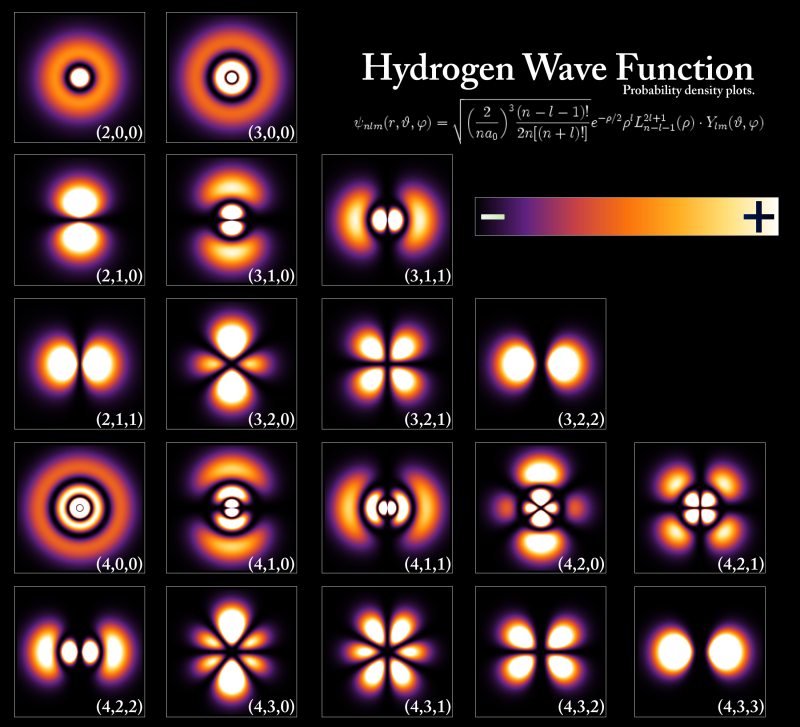
tienen la siguiente representación gráfica:
Finalmente damos nombre a nuestras
constantes de separación, que llamaremos números cuánticos porque,
como hemos visto, adoptan valores discretos (no continuos):
n es el número cuántico
principal
l es el númnero cuántico de
momento angular y
m es el número cuántico
magnético.
Ya podemos comprender la imagen del comienzo de la entrada sabiendo que los números entre paréntesis corresponden a los tres números cuánticos. Y ya está. Lo demás son detalles.

5 comentarios:
Maravilloso.
Creo que esta entrada la tendré que enseñar el año que viene si sigo dando clases de matemáticas a los químicos.
Estupendo. Creo que es la mejor explicación que he visto hasta el momento... pero claro! no he visto muchas (estoy acabando 2º Bach.->COU) Aún así se me ha hecho muy claro (aunque sé que para la mayoría de mis amigos no lo sería tanto) Ahora tengo un significado físico para esos números y ál ver una EdS entiendo a qué se refiere.
Un par de aclaraciones:
Sobre "Las condiciones que deben cumplir las soluciones (que sean cuadráticamente integrables) obligan a..." La razón de que sean cuadráticamente integrables es que en mecánica cuántica las probabilidades de que un sistema físico esté en un estado concreto se calculan mediante la integral de la función de onda al cuadrado. Por ello, solo tienen sentido físico las funciones de onda cuyo cuadrado es integrable (es decir cuya integral tenga un valor finito), de ahí la importancia de imponer esta condición.
Por otro lado. Supongo que los alumnos de química habrán estudiado en primer curso álgebra lineal y lo que es un problema de autovalores para una matriz (A*x=lamba*x); toda matriz de dimensión n tiene n autovalores y si la matriz es simétrica (o hermitiana en el caso complejo) cada autovalor tiene asociado un autovector linealmente independiente a los demás (ortogonalizable); por tanto un vector x en el espacio R^n se puede escribir en una base de autovectores de una matriz simétrica (o hermitiana).
El problema H*Ψ = E*Ψ también es un problema de autovalores; H no es una matriz es un operador diferencial y Ψ no es un vector sino una función, pero en esencia es lo mismo; las soluciones de esta ecuación, los valores posibles para E son autovalores de H y las funciones de onda correspondiente son sus autovectores asociados (en matemáticas decimos autofunciones). Como H es un operador hermitiano (similar a un matriz simétrica), sus autofunciones son linealmente independientes y ortogonalizables y definen una base del espacio de todas las soluciones de la ecuación de Schrödinger. Interesan las Ψ que tengan cuadrado integrable (y por tanto permita calcular probabilidades); las autofunciones del operador H de cuadrado integrable forman una base del espacio de todas las soluciones de cuadrado integrable (los matemáticos le llaman a este espacio L2).
Una matriz simétrica tiene n autovalores diferentes y un operador (hermitiano) como H tiene una sucesión infinita de autovalores diferentes. Como H tiene ciertas simetrías (el potencial b/r tiene simetría esférica) hay autovalores degenerados, con la misma energía, pero cuyas funciones son linealmente independientes, luego cada valor de energía (dado por n) tiene que haber otros números cuánticos que "diferencien" entre estas autofunciones para que sean linealmente independientes. La simetría rotacional implica dos grados de libertad (θ y φ) con lo que tiene que haber dos números cuánticos asociados a cada uno de ellos (sean l y m) que diferencien las autofunciones degeneradas con el mismo valor de n y de la energía.
Con un poco de teoría de grupos (de Lie) se puede demostrar que l y m tienen que tener las propiedades que se indican en la entrada, sin necesidad de resolver ninguna ecuación diferencial. Solo la simetría es suficiente para ello. En mi opinión es mejor una derivación de este tipo que la resolución de una ecuación en derivadas parciales. Lo que no sé es si los químicos estudiarán teoría de grupos (pero deberían por sus aplicaciones a la hora de entender los orbitales moleculares).
No aburro más. Un saludo,
Francis
Los alumnos de químicas, en la Universidad de Sevilla, estudian ,digamos, la tercera parte de un cuatrimestre de álgebra lineal (diagonalización, fundamentalmente).
De teoría de grupos... nada o casi nada (al menos en matemáticas).
Las 2/3 partes del cuatrimestre estudian cálculo diferencial e integral de varias variables y resolución de ecuaciones diferenciales ordinarias muy facilitas.
Despoués, en un segundo cuatrimestre, estudian algo de estadística y cálculo numérico.
En toal dan 12 créditos de matemáticas de 240.
Todo ello, gracias a la Conferncia de Rectores de Química de Andalucía, que se pasó por el forro de sus caprichos el libro blanco del Grado en Química, que decía que hubiera, al menos 24 créditos, es decir, 2 asignaturas anuales).
Una gran explicación, César. Me has refrescado el empolle que me pegué en su día del libro Química cuántica (Levine) traducido por profesores míos en la carrera.
Respecto al improvisado minidebate que apunta Eliatron, en su día (plan antiguo) y en Murcia, la facultad se llamaba de Ciencias Químicas y Matemáticas y la presencia de esta última disciplina tenía mucho peso en la carrera de Químicas. Cálculo, álgebra, estadística... pero nada de Teoría de grupos. Aún así, y tras 1 asignatura anual de 5 en 1º y 2º de carrera, la base matemática creo que era insuficiente.
En fin. Los tiempos cambian, y parece que no a mejor.
Saludos
Publicar un comentario