El cristal de tu ventana
realmente no es un cristal, es un vidrio compuesto de sílice (óxido
de silicio). Ese mismo vidrio, algo más puro, se emplea como
aislante por los fabricantes de los chips que gestionan el
dispositivo que estés empleando para leer este texto. Esto podría
llevarnos a creer que la estructura del vidrio de sílice es algo
conocido y dominado, no habría más que ver la cantidad de elementos
decorativos de formas muy elaboradas que se hacen en vidrio o la
potencia de cálculo de algunos microprocesadores. Y nada más lejos
de la realidad. Hasta ahora se viene tocando de oídas basándose en
una teoría elaborada hace 80 años. Sólo recientemente se ha podido
comprobar experimentalmente a nivel atómico esta teoría, lo que
tendrá sus implicaciones para la industria de los semiconductores y
la de los catalizadores.
En 1932 W.H.
Zachariasen publicó The Atomic
Arrangement in Glass [1], un artículo
clásico que ha sido probablemente el más influyente en la historia
del vidrio. En este artículo Zachariasen dio a la comprensión de la
estructura del vidrio y su relación con la composición su base
científica. Intuitivamente se hablaba de sólidos amorfos y, algo
más tarde, se afirmaba que un vidrio era un material sólido que
tenía la estructura de un líquido. La imposibilidad de aplicar la
difracción de rayos X para determinar la estructura atómica llevaba
a estas imprecisiones. Zachariasen, sin embargo, afirmó que un
vidrio es una red tridimensional extensa de átomos que forma un
sólido que carece de la periodicidad a larga distancias (una
ordenación repetida) de los cristales. Pero eso no implica que no
tenga orden a corto. Zachariasen llegó a proponer una reglas (pueden
consultarse aquí) para la ordenación a corto que nunca se han comprobado
experimentalmente pero que, en la práctica, son capaces de explicar
los comportamientos macroscópicos observados.
En una serie de trabajos [2,3,4] el equipo encabezado
por Leonid Lichtenstein, del Instituto Fritz Haber (Alemania) ha
conseguido observar por primera vez de forma directa los elementos
característicos de la estructura y los patrones que aparecen en
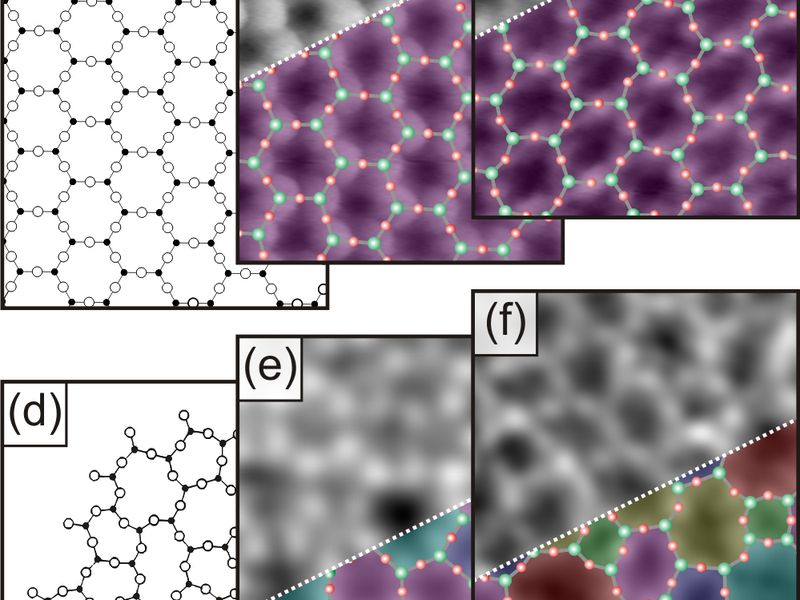
ella. Tal y como predijo Zachariasen la estructura corresponde a un
átomo de silicio rodeado por tres átomos de oxígeno, exactamente
igual que en la sílice cristalina. Sin embargo, la sílice
cristalina forma un panal de abeja regular compuesto exclusivamente
por hexágonos en un plano, mientras que en el vidrio los anillos, si
bien los hexágonos son las estructuras más frecuentes, también se
forman desde rectángulos a anillos de más de nueve átomos.
Los investigadores, ante la imposibilidad de emplear
difracción de rayos X, decidieron determinar la posición de los
átomos uno a uno (literalmente). Para ello diseñaron un modelo
bidimensional de un vidrio. Produjeron en una cámara de vacío ultra
alto sólo dos capas atómicas de sílice sobre un sustrato de
rutenio previamente recubierto por una capa de oxígeno. Dependiendo
de la temperatura durante la preparación de la muestra y de la
cantidad de sílice y oxígeno presentes los investigadores podían
obtener desde una estructura completamente amorfa a otra
completamente cristalina o una mezcla de las dos. En cualquier caso
la estructura era completamente plana.
En primer lugar, usando un microscopio de efecto
túnel Lichtenstein et al determinaron la posición de los
átomos de oxígeno. Estos datos ya ponían de manifiesto las
estructuras de Chachareasen. Posteriormente las estructuras fueron
completamente confirmadas con un microscopio de fuerza atómica que
también puede detectar los átomos de silicio. Esto es, consiguieron
obtener una imagen precisa de todas las posiciones atómicas de un
vidrio bidimensional.
Los investigadores también investigaron la
transición entre la sílice amorfa y la cristalina. En la frontera
la homogeneidad de los hexágonos de la estructura cristalina empieza
a dejar paso a pentágonos y heptágonos. Conforme más se avanza en
la parte amorfa más desviaciones aparecen en el número de átomos
por anillo.
Estos datos no sólo permitirán conocer mejor las
características de los vidrios empleados en la industria de los
semiconductores, también arrojarán luz sobre el uso de la sílice y
otros óxidos como catalizadores.
Esta entrada es una participación de Experientia docet en la XIX Edición del Carnaval de Química que organiza Leet mi explain
Referencias:
[1] WH Zachariasen (1932). The
atomic arrangement in glass. J. Amer. Chem. Soc., 54
[2] Lichtenstein L, Heyde M, & Freund HJ (2012). Crystalline-vitreous interface in two dimensional silica. Physical review letters, 109 (10) PMID: 23005304
[3] Lichtenstein, L., Heyde, M., & Freund, H. (2012). Atomic Arrangement in Two-Dimensional Silica: From Crystalline to Vitreous Structures The Journal of Physical Chemistry C, 116 (38), 20426-20432 DOI: 10.1021/jp3062866
[4] Lichtenstein, L., Büchner, C., Yang, B., Shaikhutdinov, S., Heyde, M., Sierka, M., Włodarczyk, R., Sauer, J., & Freund, H. (2012). The Atomic Structure of a Metal-Supported Vitreous Thin Silica Film Angewandte Chemie International Edition, 51 (2), 404-407 DOI: 10.1002/anie.201107097
[3] Lichtenstein, L., Heyde, M., & Freund, H. (2012). Atomic Arrangement in Two-Dimensional Silica: From Crystalline to Vitreous Structures The Journal of Physical Chemistry C, 116 (38), 20426-20432 DOI: 10.1021/jp3062866
[4] Lichtenstein, L., Büchner, C., Yang, B., Shaikhutdinov, S., Heyde, M., Sierka, M., Włodarczyk, R., Sauer, J., & Freund, H. (2012). The Atomic Structure of a Metal-Supported Vitreous Thin Silica Film Angewandte Chemie International Edition, 51 (2), 404-407 DOI: 10.1002/anie.201107097


3 comentarios:
Es increible como la naturaleza ha creado estructuras y cosas tan perfectas, con una perfeccion incrible. Tambien es bueno que las personas aprendamos de l naturaleza para construir o inventar algo, en la naturaleza esta la base de todo.
Saludos,
Joe | Recetas Faciles
Trabajé varios años en un sector que funcionaba con materiales vítreos, y me ha encantado tu frase "en el vidrio, tocamos de oído" porque estás en lo cierto. Recuerdo que cuando queríamos hacer un vídeo más duro, le añadíamos alúmina antes la cocción. Si añadías muy poca alúmina, menos del 5%, el vidrio se volvía más brillante y blando; si añadías más de esa cantidad, el vidrio endurecía y se hacía mate. Ninguno de nosotros lo entendíamos.
Buena artículo, me ha parecido especialmente interesante la transición entre la sílice amorfa y la cristalina.
Publicar un comentario