Hasta ahora la estructura de la proteína de un receptor de glutamato intacto era desconocida. Eso es lo que ha conseguido elucidar un equipo dirigido por Eric Gouaux de
La transmisión de señales entre las neuronas se produce, habitualmente, por la liberación de un neurotransmisor en la sinapsis. Este neurotransmisor, glutamato, por ejemplo, es capaz de unirse a una proteína situada en la membrana de la célula postsináptica, en nuestro ejemplo un receptor de glutamato. Este acoplamiento, que es específico, sólo el glutamato se acopla con su receptor, abre un canal de iones en la membrana que permite la entrada o salida de iones (dependiendo del neurotransmisor que se trate), lo que provoca un cambio en la diferencia de potencial en la membrana, que se transmite a lo largo de la neurona. De esta forma se transmite la señal nerviosa tanto en el cerebro como en el resto del sistema nervioso.
La importancia de las neuronas glutamatérgicas (que segregan glutamato como neurotransmisor), entre otros, en los procesos de la memoria y del aprendizaje es altísima, de aquí la importancia del descubrimiento. El cuadro resultante, además, ha puesto de manifiesto subestructuras que han conseguido sorprender a los investigadores por lo inesperadas.
El equipo de investigadores estudió un receptor de glutamato de rata llamado GluA2. Aislaron las proteínas a partir de las neuronas y consiguieron hacer crecer un cristal a partir de ellas. Para ello bloquearon la conformación en la posición “cerrado”, para favorecer tanto la cristalización como el posterior análisis. Este cristal fue analizado por dispersión de rayos-X, con lo que se consiguió producir una representación tridimensional a nivel atómico de la estructura de una sola proteína.
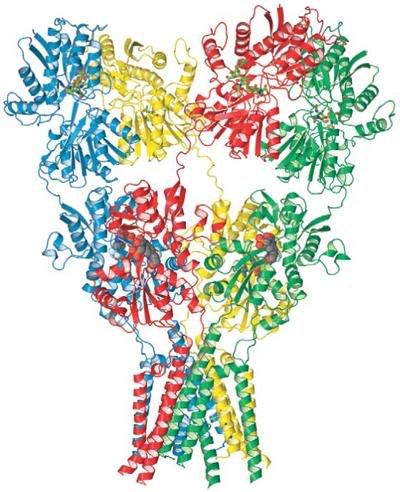
El receptor GluA2 tiene la forma de una letra Y, y tiene tres partes principales. En la parte de arriba están los dos brazos de
Ahora viene lo sorprendente. El receptor tiene cuatro subunidades, químicamente idénticas, pero que ¡se pliegan de diferente forma! Dos subunidades son completamente diferentes de las otras dos [véase la imagen, cortesía de E. Gouaux et ál.].
La forma de este receptor puede ser ahora tenida en cuenta para diseñar moléculas que puedan funcionar como fármacos que se unan a él. No sólo eso, resultados anteriores, que se basaban en conjeturas sobre la estructura del receptor, pueden ahora ser revisitados con este nuevo conocimiento.
Referencia:
Sobolevsky, A., Rosconi, M., & Gouaux, E. (2009). X-ray structure, symmetry and mechanism of an AMPA-subtype glutamate receptor Nature DOI: 10.1038/nature08624
No hay comentarios:
Publicar un comentario
Por favor, cuida la ortografía y la gramática. Gracias.
Nota: solo los miembros de este blog pueden publicar comentarios.