Imagina una molécula orgánica rodeada de un gas inerte a temperaturas cercanas al cero absoluto, y nada más. ¿Cómo estará dentro de una hora? El razonamiento estándar diría que cinéticamente (por velocidades de las posibles reacciones) no habría cambio y termodinámicamente (por las barreras de energía potencial tan grandes que tendría que superar) tampoco. Un grupo de investigadores encabezados por Peter Schreiner, de la Universidad Justus-262 C ), sólo para darse cuenta de que no sólo se descompone en esas condiciones, sino que además lo hace para dar la molécula que no debería. La conclusión: la reacción no está controlada por la cinética o la termodinámica en el sentido clásico, sino por un efecto mecanocuántico, el efecto túnel. Los resultados se publican en Science.
Si nos fijamos en la imagen de arriba la molécula que aparece en el centro es el metil-hidroxi-carbeno. A la izquierda vemos una bola gris más grande enlazada a otras tres más pequeñas, la primera es un carbono y las segundas hidrógenos, y el conjunto es el metil. A la derecha una bola oscura está unida a una gris más pequeña, la primera es un oxígeno que con la segunda (hidrógeno) forma el grupo hidroxi. Ambos grupos, metil e hidroxi están unidos a un átomo central de carbono. Si te fijas el átomo de carbono central sólo tiene dos enlaces en vez de los cuatro habituales, es decir, tiene dos electrones “sueltos”, con lo que la estructura queda así CH3-C:-OH, formando un carbeno, una de las especies intermedias más reactivas de la química orgánica.
El objetivo del grupo de investigadores era precisamente este, conseguir esta molécula. Pero mientras realizaban los análisis de comprobación se dieron cuenta de que conforme pasaba el tiempo iba apareciendo otra especie. Unos cálculos rápidos de barreras de potencial (hasta dónde tiene que subir la energía de la molécula como para poder descomponerse en otra cosa) mostraban que la barrera a superar para que se transformase en alcohol vinílico era menor (22, 6 kcal/mol) que la correspondiente al acetaldehído (28 kcal/mol), por lo que lo más probable era que la nueva especie fuese el alcohol. [En la imagen vemos esto gráficamente: la gráfica es una representación de la energía potencial, la molécula central es el carbeno, a la izquierda vemos el alcohol y a la derecha el aldehído, en las crestas las especies intermedias. Cada especie lleva asociado su valor energético]. Análisis posteriores indicaron que el carbeno no se descomponía en alcohol, sino en acetaldehído. ¿Cómo era posible?
Como vemos la única diferencia en las dos reacciones posibles es qué hidrógeno cambia de lugar: en el caso del alcohol un hidrógeno del metilo “se va” al carbono central que a su vez forma un doble enlace con el carbono del metilo; en el caso del aldehído es el hidrógeno del hidroxilo el que se va al carbono central que forma doble enlace con el oxígeno. Viendo estos mecanismos podemos intuir por qué la reacción a aldehído es más difícil que se produzca, requiere más energía, que la que da alcohol: el oxígeno es más electronegativo que el carbono por lo que atrae más al protón (el hidrógeno) de lo que lo hace el carbono, y le costará más soltarlo.
Acabamos de nombrar la clave del asunto, los hidrógenos son protones. ¿Qué pasaría si usamos deuterones? Es decir si en vez de los átomos de hidrógeno más comunes con un protón en el núcleo usamos átomos con un protón y un neutrón, doblando de esta forma su masa. Este es precisamente el experimento que realizaron los investigadores. Y encontraron que el carbeno deuterado no se descomponía, tal y como predice la teoría química clásica. Por lo tanto, la masa de los núcleos de hidrógeno era un factor importante, claro indicio de que era un efecto cuántico el que estaba determinando la reacción, el efecto túnel.
Volvamos a la gráfica de arriba y la considerémosla como el perfil de una cordillera montañosa. Los cicloturistas Carbeno y su primo rico Carbeno-Deuterado están en un valle entre dos montañas, están cansados, tienen poca energía y las montañas a uno y otro lado se les hacen infranqueables; si no tuviesen más remedio que ir a uno de los dos pueblos cercanos, Villalcohol y Corrales de Aldehído, se decantarían por la subida menor y elegirían Villalcohol. Pero resulta que existe un túnel hacia Corrales de Aldehído que, por extraño que parezca, tiene una limitación de masa. Carbeno que viaja más ligero lo puede atravesar y Carbeno-Deuterado se queda donde está.
¿Por qué ocurre esto? Simplificando, el protón es lo suficientemente pequeño como para que la dualidad onda-corpúsculo tenga efectos significativos en su comportamiento, mientras que en el núcleo de deuterio la masa ya es un poco demasiado grande. Si se describe la posición de un protón que se desplaza hacia la montaña (que representa la barrera de potencial) en términos de su función de onda existe una probabilidad muy pequeña, pero no nula, de que se encuentre al otro lado de la barrera de potencial, es decir, de que la atraviese; esto es el efecto túnel.
Pero la forma de las barreras también influye en la probabilidad de que sean atravesadas por el efecto túnel. La capacidad de poder penetrar una barrera depende de la “subida”, la diferencia en energía entre el carbeno y las crestas (para ser precisos de su raíz cuadrada), y la anchura de la barrera. Haciendo los cálculos para ambas barreras, la del alcohol es del orden de un 20% más ancha. Cuando se consideran todos los factores es más de mil veces más probable el efecto túnel hacia el aldehído que hacia el alcohol.
Para que nos hagamos una idea de los órdenes de magnitud que estamos hablando, consideremos que la probabilidad de pasar por el túnel hacia el aldehído es de 10-18, es decir, que de cada 1018 veces que un protón se dirija hacia la barrera solo 1 la atravesará. En la matriz de argón y a 11 K un protón se dirige hacia la barrera un numero suficiente de veces como para que resulte una vida media para el carbeno de alrededor de una hora, en concordancia con las observaciones.
A los que hemos estudiado química en algún momento de la carrera, en concreto cuando se plantea la teoría de los estados de transición, se nos menciona que pueden ocurrir fenómenos mecanocuánticos, pero que, a efectos prácticos, siempre se descartan. Este estudio muestra un caso en el que el efecto cuántico es crítico. Y seguro que hay muchos más si se buscan.
Puede que algún día a los estudiantes de grado se les enseñe que una reacción puede estar bajo control termodinámico, cinético o de túnel.
Esta entrada es una participación de Experientia docet en la V Edición del Carnaval de Química que alberga Scientia y en la XX Edición del Carnaval de Física que alberga Resistencia Numantina.
Esta entrada es una participación de Experientia docet en la V Edición del Carnaval de Química que alberga Scientia y en la XX Edición del Carnaval de Física que alberga Resistencia Numantina.
Referencia:
Schreiner, P., Reisenauer, H., Ley, D., Gerbig, D., Wu, C., & Allen, W. (2011). Methylhydroxycarbene: Tunneling Control of a Chemical Reaction Science, 332 (6035), 1300-1303 DOI: 10.1126/science.1203761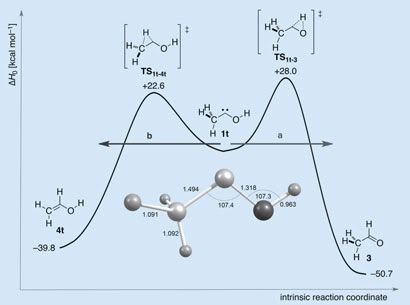

6 comentarios:
El título será pasto para los magufos!! :D
"Las reacciones químicas también pueden estar controladas por efectos cuánticos"
Ahora se podrá "explicar" la homeopatía y demás ;)
Te lo compro. Cambiado.
Muchas gracias.
Enhorabuena por este brillante artículo.
Me gustaría hacerte una pregunta. ¿Por qué no existen (al menos yo no he oido hablar nunca de ellos) los microscopios protónicos?. Serían mejores que los electrónicos, al igual que éstos son mejores que los ópticos. De tu artículo deduzco que ya no existirían nunca los "microscopios deuteronicos". Gracias.
@Antonio Palacio.
Muchas gracias por el comentario. Date cuenta que encierra una contradicción: si el deuterio no lo puedes usar por su masa, ¿por qué el protónico sería mejor que el electrónico?
Buenas Tardes. César, no veo la contradicción: el deuterio tiene una masa demasiado grande para estar bajo los efectos de la mecánica cuántica, pero el protón (tal y como tu artículo también dice), el electrón y el fotón (es el que usamos en los microscopios ópticos) tienen una masa mas pequeña y sí están sometidos a las leyes de la mecánica cuántica. El protón, desde mi modesto punto de vista, sería mejor que el electrón, ya que al tener mayor masa, la longitud de onda de su onda asociada sería menor y al ser esta longitud de onda la que nos determina la dimensión del objeto que podemos ver (fenómeno de difracción), obtendríamos una mayor resolución que con el microscopio electrónico. Gracias.
Publicar un comentario